Warning: Undefined property: stdClass::$subjects in /home/clients/35666af5317ba4b26577e5dc7df1a2a0/web/wp-content/plugins/openbook-book-data/openbook.php on line 222
Je viens de découvrir chez Ask A Mathematician/Physicist une réponse à la question que je me posais depuis la lecture du « Berceau du Chat », encore un vieux mais bon livre de S.F [1]. Je traduis l’article complet:
Question: Est-il possible de créer une substance comme la Glace-neuf de Kurt Vonnegut, qui pourrait se lier à l’eau, en particulier l’eau de mer et se répliquer comme un virus en solidifiant les océans et toute l’eau sur Terre?
Réponse du Physicien : Non. En fait il existe une Glace IX, mais elle n’a rien de spécial.
Les cristaux sont en général « auto-réplicants ». Une fois qu’un cristal est présent, la matière première environnante qui se place dans dans le réseau cristallin cause une baisse de l’énergie totale, mais bizarrement il faut dépenser un peu d’énergie pour commencer le cristal. Vous pouvez voir ceci en action avec de l'eau surfondue : l’eau est tellement froide qu’elle devrait geler, mais aucun arrangement des molécules d’eau ne permet de commencer le cristal de glace.

Le premier minuscule cristal qui démarre la boule de neige est appelé un « germe ». Souvent il n’est pas nécessaire car des impuretés de l’environnement peuvent ressembler à du cristal et les groupes d’atomes prêts à cristalliser peuvent s’y déposer. On appelle ces impuretés des « sites de nucléation ».
Il pourrait paraître étrange de parler de formes d’eau solide différentes de la « glace » habituelle, mais il faut se souvenir que de nombreuses substances sont capables de cristalliser de plusieurs manières. Par exemple le saphir et le rubis sont fait d’exactement la même matière, l’oxyde d’aluminium, simplement arrangé différemment en fonction de l’environnement dans lequel ils se forment. (Note du 10.11.12: ceci n’est pas correct. Comme Ethaniel l’a soulevé dans un commentaire.)

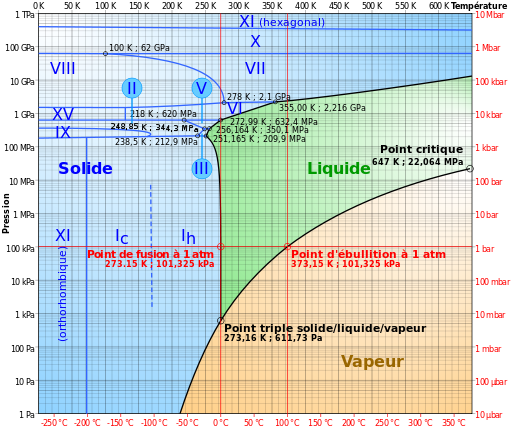
L’eau en particulier cristallise sous un nombre surprenant de formes. Jusqu’ici, on a découvert 15 formes différentes de glace d’eau, mais une seule peut se former naturellement sur la Terre, la Glace-I. Même au fond de la fosse des Mariannes, la pression n’est de loin pas suffisante pour une autre forme de glace.
Une règle générale est que si quelque chose veut cristalliser et se trouve dans un environnement ou c’est possible, ça arrivera. Même s’il n’y a pas de germe cristallin présent, un site de nucléation apparaîtra tôt ou tard et le cristal pourra se former et croître.
L’idée de la glace-9 de Vonnegut est qu’il pourrait exister une forme cristalline de l’eau qui cristallise rapidement à la pression et température de la surface terrestre. Si ça se pouvait, alors à un certain moment en quelques milliards d’années, à un certain endroit de nos gigantesques océans, un petit cristal de glace-9 aurait du apparaître et envahir le monde.
Nous avons déjà vu ça sur d’autres mondes précisément baptisés « lunes glacées ». Par exemple, Europe a beaucoup d’eau, et son environnement (pression et température) permet la formation de glace-I. Sans surprise, Europe a subi il y a longtemps une « catastrophe du type Glace-I » qui a solidifié toute son eau, du moins à sa surface.
Pour résumer, si l’eau terrestre avait trouvé un moyen de cristalliser à température ambiante, elle l’aurait fait dès que possible, il y a très longtemps.
Bon, je retiens quand même qu’on a toujours pas démontré que la glace-I correspond à un minimum global d’énergie de l’eau à pression/température ambiante, et que le fait que la glace-I soit la seule des 15 (?) à avoir une densité inférieure à 1 permet de maintenir le suspense science-fictionnesque.
Référence: Kurt Vonnegut "Le Berceau du chat" (1972) Seuil ISBN:9782020016216 WorldCat Goodreads Google Books





15 commentaires sur “La glace-9 de Vonnegut peut-elle exister ?”
Pour en revenir au point 3-a) je pense que le fait de dire de la proteine qu elle « decide » est le fruit de l accumulation des interrogations sur le sujets (comme on en trouve dans les points 1- et 2-).
Dans cet article de Science Etonnante sur les prions et la maladie de la vache folle, David a une idée intéressante d’analogie entre le pliage « rare » de certaines protéines et la glace 9. Mais il s’est aperçu que quelqu’un d’autre avait eu la même avant : http://dx.doi.org/10.1016/1074-5521(95)90074-8
Je sais que ce topic à plus de deux ans mais je suis tombé sur un article où ils parlent de Ringwoodite, j’y colle le le lien: http://fr.wikipedia.org/wiki/Ringwoodite#cite_ref-1
J’attends pour voir si l’un de vous réagit avant de me prononcer
A plus
J’ai vu passer aussi cette info, mais je ne vois pas bien le rapport avec l’article … En fait je ne vois même pas ce qui permet de considérer de l’hydroxyde comme de l’eau. Selon https://fr.wikipedia.org/wiki/Hydroxyde le centre de notre galaxie contient un gros nuage d’hydroxyde et personne ne prétend que c’est de l’eau. Pour faire de l’eau, à ma connaissance, il faut oxyder de l’hydrogène moléculaire, H2. Je ne sais pas quelle molécule peut réagir avec HO- pour produire H2O.
La glace-9 n’existe probablement pas, mais il y a mieux – allez au fond de la mer (au-delà de quelques centaines de mètres) :
– Pression élevée
– Grande quantité d’eau disponible (of course…)
– Méthane de la décomposition des matières organiques mortes tombant au fond
Vous obtenez à partir d’un liquide (l’eau) et d’un gaz (le méthane) des substancess solides : des hydrates de méthane qu’on appelle couramment « clathrates » (catégorie plus générale des molécules encagées dans l’eau) !
À suffisamment basse température (vers 4°C, fonds marins), il peuvent exister à moins de 300 m de profondeur (2e & 3e lien). Noter la très forte destabilisation avec l’augmentation de la température, qui est source de scénarios climatiques catastrophiques (ou catastrophistes ?, voir 3 & 4e lien), en raison du très fort effet de serre dû au méthane (rétroaction positive)…
Liens :
http://fr.wikipedia.org/wiki/Hydrate_de_méthane
http://marcvaldez.blogspot.ch/2010/05/methane-clathrate-hydrate-stability.html
http://ethomas.web.wesleyan.edu/ees123/359snow.htm
http://en.wikipedia.org/wiki/Clathrate_gun_hypothesis
Encore du combustible qu’on pourra brûler ? Cool … Je veux dire hot !
https://drgoulu.com/2007/05/25/on-brulera-vraiment-tout/
Un nouvelle forme de glace, la XVI, vient d’être produite en labo à partir d’un clathrate de néon « vidé » en pompant le néon. http://www.journaldelascience.fr/physique/articles/chimistes-creent-nouveau-type-glace-4353
« Même au font de la fosse des Mariannes »
Ne serait-ce pas plutôt au « fond » 😉 ?
Je dévie un peu du sujet, désolé, mais un point m’interpelle : « Par exemple les saphirs et les rubis sont fait d’exactement la même matière, l’oxyde d’aluminium, simplement arrangé différemment en fonction de l’environnement dans lequel ils se forment. »
Je ne suis aucunement spécialiste des pierres précieuses, mais il me semblait que la différence de coloration entre saphir et rubis n’était pas liée à la structure cristalline, identique, mais aux impuretés : me trompé-je ?
Par contre, pour le cas graphite/diamant, la différence de structure est effectivement de notoriété publique.
J’ai corrigé la typo et tu reçois un bon point de lecture attentive, bravo !
Effectivement, il semblerait que la structure cristalline du saphir et celle du rubis soient les mêmes, et d’ailleurs l’image de la wikipédia se rapporte aux deux. Dans le rubis il y a suffisamment de chrome pour qu’il apparaisse dans la formule Al2O3:Cr alors que pour le saphir on indique Al2O3 tout court. De plus cette page indique des propriétés identiques pour les deux, à part la formule.
Donc tu ne te trompes point, cet exemple n’est pas bon, je corrige ça aussi avec notification à AskAPhysicist comme quoi il leur faut aussi un AskAChemist. Merci !
Ceci dit il y a quand même plein de formes cristallines de l’alumine ! La forme la plus dense et la plus dure est l’alumine alpha, mais il y a aussi l’alumine beta, gamma, theta…
En cherchant vite fait comme ça je n’ai pas trouvé le diagramme de phase, mais je dois l’avoir quelque part dans ma biblio !
Est-ce que vraiment on n’a pas demontré (calculé) que la glace I est la forme qui a l’énergie libre minimale ?
Du coup l’argument de « un cristal de glace-9 se serait forcément forme un jour » ne me convainc pas complètement sur un plan strictement théorique. Imaginons que la glace-9 soit effectivement la forme thermodynamiquement la plus stable à température/pression ambiante, mais que l’eau liquide soit separée de cette forme par une énorme barrière de potentiel. Alors l’état liquide pourrait bien être un état métastable, comme l’eau en surfusion.
En lisant http://en.wikipedia.org/wiki/Ice_Ih#Proton_disorder , il semblerait que les glaces II et XI soient plus stables que la glace ordinaire Ih. Sinon, on trouve des infos sur la quinzaine de glaces connues dans une table sous la figure de phase de http://en.wikipedia.org/wiki/Ice_XIV#Phases . C’est juste hallucinant que cette petite molécule tout bête puisse cristalliser d’autant de manières !
Bravo pour cet article, très intéressant.
Une question me taraude: Si l’on crée artificiellement un cristal d’eau de l’une des 14 autres formes. Est-il possible, une fois formé, de le maintenir sous sa forme cristalline dans un environement « normal » ou ceux-ci se disloquent-t-ils instantanément . Ou en clair peut-on avoir un glaçon qui coule dans son verre de Whisk… euh limonade au lieu de flotter? (je sais ça fait cher le glaçon :p)
Merci pour cette excellente question, à laquelle je n’ai pas de réponse définitive.
J’aurais tendance à dire que puisque le diamant formé à haute pression ne se retransforme pas en graphite en remontant à la surface de la Terre, il devrait être possible de produire par exemple de la glace VI ainsi, en regardant le diagramme de phase de l’eau de l’article :
Prendre de l’eau à 20° à la pression ambiante (1 bar) et augmenter sa pression jusqu’à 10 kbar. On arrive ainsi sur la transition de phase oblique entre liquide et glace VI. Là on refroidit à, disons, -75°C en maintenant la pression, puis on abaisse la pression à 1 bar pour obtenir des glaçons plus denses que l’eau pour votre limonade et mon whisky.
Mais on traverse ainsi la zone de la glace II avant d’entrer dans celle de la glace I et je pense qu’il pourrait se passer des choses à ces transitions, car sinon il serait impossible d’obtenir les glaces II, VIII et IX qui n’ont pas de frontière avec la phase liquide, sans parler des X et XI (j’avais oublié ce qu’est le point critique, très bien illustré sur la wikipédia )
Maintenant que j’y réfléchis, je pense qu’il faut connaitre les niveaux d’énergie associés à ces diverses formes cristallines. Le graphite se transforme en diamant lorsqu’il est comprimé, mais ne redevient pas du graphite en relâchant la pression parce que le diamant est « plus stable », donc à un niveau d’énergie inférieur. Dans cette perspective, les autres glaces ne pourraient survivre à pression ambiante que si elles sont plus stables que la glace I.
Je demande confirmation à l’auteur de l’article anglais.